They understood how the immune system is kept in check: è questo il titolo dell’articolo col quale sul sito Nobel Prize è illustrata la motivazione del premio Nobel 2025 per la medicina o la fisiologia. Lo hanno ricevuto ex aequo, «per le loro scoperte sulla tolleranza immunitaria periferica», tre personalità nel campo della ricerca immunologica: fra loro una donna, Mary E. Brunkow, insieme ai suoi colleghi Fred Ramsdell e Shimon Sakaguchi.
Come spesso accade nel caso della medicina e della fisiologia, questo importante riconoscimento arriva non al momento della scoperta, ma dopo che questa è stata coronata da numerose conferme e ha cominciato a dare i suoi frutti, migliorando le possibilità di cura di molte e gravi malattie.
Nell’intervista telefonica, concessa subito dopo l’annuncio e pubblicata sul sito Nobel Prize, Mary E. Brunkow racconta: «È stato un incredibile lavoro di squadra quando abbiamo fatto quel lavoro. La mia carriera scientifica è cambiata parecchio [da allora]. E in realtà non lavoro nemmeno più in quel campo specifico. Quindi è un onore aver preso parte a quel lavoro iniziale. Ho seguito cosa sta succedendo in medicina e come quella scoperta avrebbe potuto aiutare in qualche piccolo modo».
Senza dubbio la scoperta per la quale Mary e i suoi colleghi hanno meritato il premio Nobel è stata davvero un importante punto di partenza per la ricerca nel campo biomedico.
Il nostro sistema immunitario è un meccanismo perfetto, un vero capolavoro dell’evoluzione, ma come fanno le cellule immunitarie a riconoscere i microrganismi patogeni e a combatterli, senza attaccare organismo che devono difendere? Ce lo spiega molto bene l’articolo sul sito Nobel Prizeche abbiamo citato all’inizio. Le cellule che governano questo complesso meccanismo sono un’importante categoria di linfociti, detti linfociti T perché, dopo essere stati prodotti nel midollo osseo, completano la loro maturazione nel timo, una ghiandola linfatica situata nel torace, dove si differenziano a seconda della funzione che dovranno svolgere.
Alla fine degli anni ’90 era noto che nel timo vengono prodotti due principali tipi di linfociti T, denominati helper e killer: i primi sono specializzati nel riconoscimento degli agenti patogeni; i secondi hanno il compito di attaccare e distruggere le cellule infettate da un agente patogeno o quelle tumorali, dopo essere state allertate dai linfociti helper.
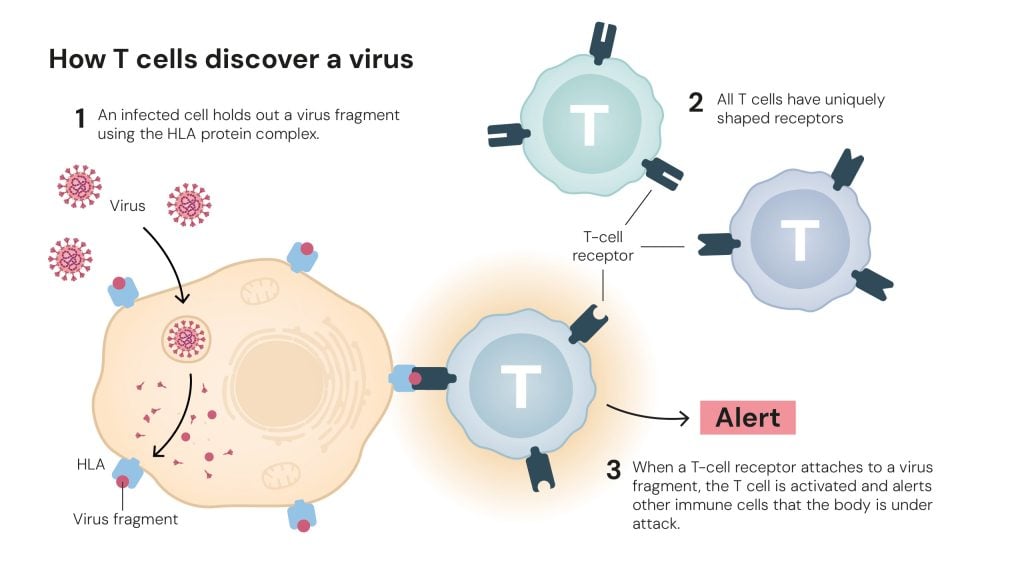
Inoltre, si sapeva che esiste un meccanismo, chiamato “tolleranza centrale”, che esclude quei linfociti helper che identificano le proteine endogene dell’organismo e le eliminano, in modo da evitare che i linfociti killer possano attaccare le cellule sane.
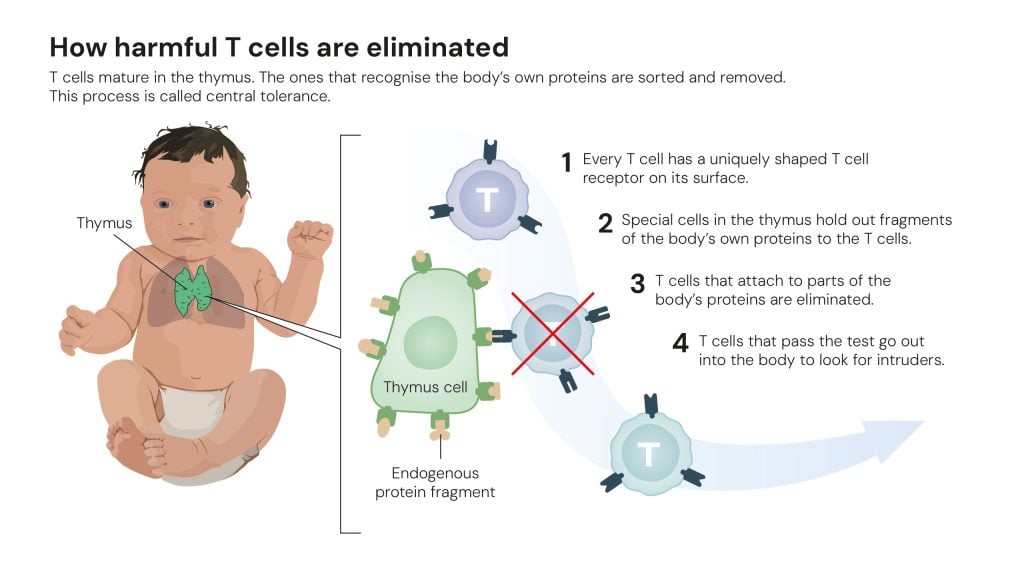
Tuttavia, questo processo non poteva essere l’unico. Doveva esistere un meccanismo che rimediava a eventuali errori.
Fu Shimon Sakaguchi, un ricercatore che lavorava presso l’Aichi Cancer center research institute di Nagoya, in Giappone, a ipotizzare per primo e poi a dimostrare sperimentalmente nel 1995 che doveva esistere un terzo tipo di linfociti T, che avevano il compito di intervenire sui linfociti helper dannosi sfuggiti alla selezione nel timo: i linfociti T regolatori.
È a questo punto che entrano in scena Mary Brunkow e Fred Ramsdell, che hanno condiviso con Sakaguchi il Nobel di quest’anno. Brunkow e Ramsdell lavoravano presso un’azienda biotecnologica, Celltech Chiroscience, a Bothell (Washington), dove facevano ricerche su una malattia autoimmune dei topi: a volte il loro sistema immunitario impazzisce e i linfociti T attaccano i tessuti sani. Si trattava di una mutazione genetica che per la prima volta si era osservata negli anni ’40 nei laboratori del progetto Manhattan, ed era stata battezzata mutazione scurfy (forfora), perché i topi che ne erano affetti avevano la pelle rugosa che tendeva a squamarsi. Sicuramente il gene responsabile si doveva trovare sul cromosoma X, perché la malattia colpiva solo i maschi, ma si era visto che poteva essere trasmessa anche dalle femmine. Le tecniche di mappatura genetica negli anni ’90 erano agli esordi e l’identificazione di questo gene richiese molto tempo e tanta pazienza, ma alla fine Brunkow e Ramsdell riuscirono a isolare il gene responsabile della malattia, Foxp3. Scoprirono anche l’equivalente umano di Foxp3, responsabile di una rara malattia genetica autoimmune, l’Ipax, la variante umana della malattia dei topi con la forfora. Nel 2001, su «Nature Genetics», Mary Brunkow e Fred Ramsdell rivelarono che mutazioni nel gene Foxp3 causano entrambe le malattie. A questo punto il puzzle era quasi completo: il passo successivo fu quello di dimostrare che Foxp3 è il gene che controlla lo sviluppo dei linfociti T regolatori.
Ci vollero ancora due anni per dimostrarlo con certezza.
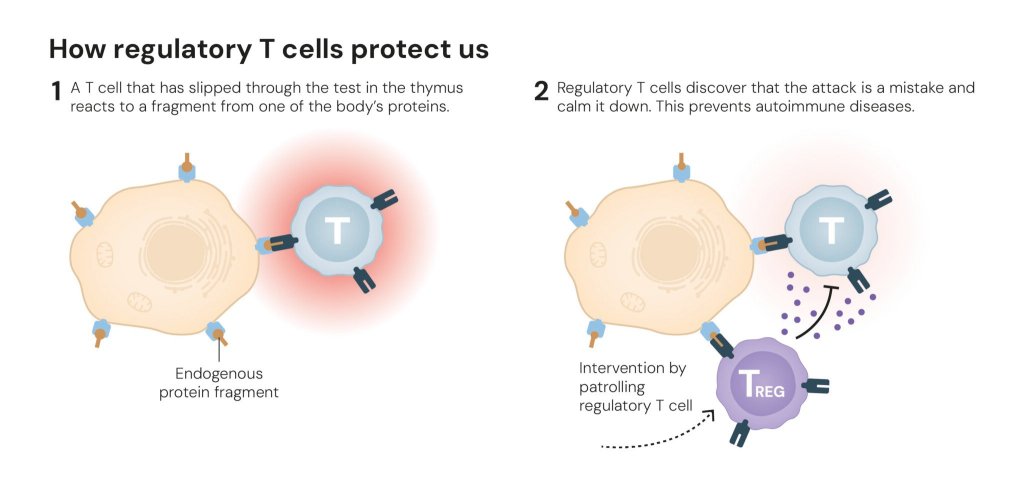
Sono proprio i linfociti T regolatori a impedire agli altri linfociti di attaccare i tessuti sani e inoltre sono ancora loro a frenare l’azione del sistema immunitario dopo che un invasore è stato eliminato. Grazie a queste scoperte, mediante la conoscenza approfondita del funzionamento del processo di tolleranza immunitaria periferica, è stato possibile lo sviluppo di molti nuovi farmaci contro le malattie autoimmuni. E non è l’unica conseguenza positiva per la scienza medica. Nei laboratori di tutto il mondo sono in corso ricerche su molte altre possibilità di cura legate a queste scoperte.
Ad esempio, si comincia a comprendere che alcune cellule tumorali hanno la capacità di attrarre un gran numero di cellule T regolatrici che le proteggono dal sistema immunitario: attaccando questo “muro” di cellule T regolatrici, si spera di aiutare il sistema immunitario a combattere molti tumori. E ancora, allo scopo di favorire la formazione di più linfociti T regolatori, si sta sperimentando la somministrando ai pazienti dell’interleuchina-2, una sostanza che favorisce la proliferazione dei linfociti T regolatori. Si spera che questa stessa sostanza possa essere utilizzata per prevenire il rigetto di organi dopo il trapianto.

Mary E. Brunkow ha raccontato di essere rimasta molto sorpresa dalla notizia, al punto di aver rifiutato la chiamata giunta in piena notte da Stoccolma sul suo cellulare, convinta che si trattasse di spam. Nelle sue prime dichiarazioni ha insistito sull’importanza del lavoro di squadra nella ricerca scientifica: «Ci vogliono un sacco di cervelli diversi, che ci lavorino tutti insieme, questo è certo», ha precisato.

Sono ancora scarne le notizie biografiche su di lei: è nata nel 1968 a Madison, Wisconsin, Stati Uniti. I suoi genitori erano Elaine Carter, un’insegnante di biologia che lavorava in una scuola superiore locale, e Richard Brunkow, un ingegnere biomedico; è la terzogenita e ultima nata della coppia ed è stata sua madre a instillare in lei, fin da piccola, la passione per la biologia umana e la genetica, incoraggiandola a leggere libri di divulgazione scientifica. Ha frequentato le scuole pubbliche di Madison e poi la St. Mary’s Academy di Portland, dove ha completato gli studi secondari nel 1979. In seguito si è iscritta all’Università del Wisconsin-Madison, dove ha conseguito una laurea in biologia molecolare nel 1983. Ha poi conseguito il dottorato di ricerca in genetica umana a Princeton nel 1991, sotto la supervisione di Shirley M. Tilghman con una tesi intitolata Espressione e funzione del gene H19 nei topi transgenici. In seguito ha ottenuto una borsa di studio post-dottorato presso il St. Jude Children’s Research Hospital, dove si è specializzata nell’analisi funzionale dei geni coinvolti nelle malattie rare. Lì ha iniziato a sviluppare le competenze di ricerca che la porteranno poi a fare scoperte rivoluzionarie.
Nei primi anni 2000, Mary Brunkow è entrata a far parte del team di ricerca dell’azienda biotecnologica Pharmacia Corporation. Qui ha partecipato al gruppo di ricerca che, studiando il meccanismo di regolazione della massa ossea, ne ha identificato il gene responsabile, LRP5, la cui scoperta è stata annunciata nel 2001 con un articolo di cui lei è co-autrice, pubblicato sulla rivista «Nature Genetics».
In seguito, per oltre un decennio, è stata professoressa associata presso l’Università di Washington, dove ha diretto il laboratorio in cui si studiavano le malattie genetiche delle ossa.
È sposata con il bioinformatico Thomas Greene, dal quale ha avuto due figli. È un’attivista per la parità di genere nella scienza e una mentore femminile in ambito accademico. Prima di vincere il Premio Nobel, Brunkow aveva già ricevuto riconoscimenti come il Premio Lasker per la Ricerca Medica Clinica (2023) e la Medaglia Mendel per la Genetica Umana. È stata eletta alla National Academy of Sciences nel 2024 e ha ricevuto lauree honoris causa da istituzioni come Harvard, Oxford e l’Università di Toronto. Inoltre, il suo lavoro continua a essere un riferimento obbligatorio negli studi sulla genetica ossea e sulla medicina personalizzata.
Per saperne di più:
https://www.buscabiografias.com/biografia/verDetalle/12632/Mary%20E.%20Brunkow
Mary E. Brunkow – Interview. NobelPrize.org. Nobel Prize Outreach 2025. Thu. 9 Oct 2025. https://www.nobelprize.org/prizes/medicine/2025/brunkow/interview/
Popular information. NobelPrize.org. Nobel Prize Outreach 2025. Thu. 9 Oct 2025.
https://www.nobelprize.org/prizes/medicine/2025/popular-information/
***
Articolo di Maria Grazia Vitale

Laureata in fisica, ha insegnato per oltre trent’anni nelle scuole superiori. Dal 2015 è dirigente scolastica. Dal 2008 è iscritta all’Associazione per l’Insegnamento della Fisica (AIF) e componente del gruppo di Storia della Fisica. Particolarmente interessata alla promozione della cultura scientifica, ritiene importanti le metodologie della didattica laboratoriale e del “problem solving” nell’insegnamento della fisica.


